Femtoquímica.
Por Lorenzo Hernández • 18 Feb, 2008 • Sección: Hablar de Ciencia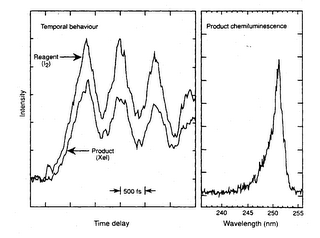 La Cinética Química es la rama de la Química que se encarga de estudiar las velocidades de reacción, es decir, la rapidez con que desaparecen los reactivos o se forman los productos en una reacción química. El estudio de las velocidades nos puede ayudar a comprender los mecanismos por lo que transcurre una reacción y es de enorme importancia en Química, baste recordar que en la industria interesa obtener producto a la mayor velocidad posible, aunque en otras ocasiones interesa frenar la velocidad de reacción como, por ejemplo, la oxidación de los metales, o la degradación de los alimentos.
La Cinética Química es la rama de la Química que se encarga de estudiar las velocidades de reacción, es decir, la rapidez con que desaparecen los reactivos o se forman los productos en una reacción química. El estudio de las velocidades nos puede ayudar a comprender los mecanismos por lo que transcurre una reacción y es de enorme importancia en Química, baste recordar que en la industria interesa obtener producto a la mayor velocidad posible, aunque en otras ocasiones interesa frenar la velocidad de reacción como, por ejemplo, la oxidación de los metales, o la degradación de los alimentos.
Suponía Arrhenius, autor de la Teoría del Complejo Activado, una de las primeras teorías sobre la cinética de las reacciones, que al iniciarse una reacción química se forma un complejo activado de alta energía, energía de activación. Esta es la energía mínima que deben de tener los reactivos para dar lugar a reacción. En 1918 Lewis propuso la Teoría de Colisiones, basada en la teoría cinética de la materia, donde introducía modificaciones: los átomos, moléculas o iones que reaccionen deben de chocar con una energía suficiente pero además hay que tener en cuenta que la orientación de las moléculas, átomos o iones sea la adecuada para que reaccionen. Es lo que se llama choques eficaces. Posteriormente se desarrolló la Teoría del Estado de Transición, la cual, está basada en consideraciones termodinámicas. Esta teoría supone que se forma la especie de transición que es inestable, aunque goza de buena parte de las propiedades de las moléculas. También puede suponerse, a efectos prácticos, que hay un equilibrio entre reactivos y estado de transición.
Los estados de transición duran del orden de los femtosegundos (10-15 s), por eso son muy difíciles de aislar. Pero en la década de 1980, investigadores del Instituto de California utilizaron trenes de pulsos láser muy cortos, de frecuencia 10 femtosegundos, para activar moléculas de ciclobutano. Cada tren de pulsos producía un espectro de absorción y los cambios en este espectro reflejaban el movimiento de las moléculas y los enlaces en el estado de transición. Comprobaron que, de los mecanismos propuestos para la descomposición del ciclobutano en etileno, el correcto era el de dos etapas con un intermediario, cuya vida es de unos 700 femtosegundos.
La femtoquímica se ha convertido, hoy, en un área de la Cinética Química, que ha permitido conocer el mecanismo de muchas reacciones químicas y biológicas.

GRACIAS…estoy estudiando Reacciones Orgánicas y ésto me fue de gran ayuda.